메디컬 B2B 플랫폼 스타트업 메디히어로즈가 코로나19 진단 팩트 체크를 공개했다.
메디히어로즈는 전 세계 코로나19 진단 제품은 약 275개에 달하고, 그중 한국산 제품이 중국산 다음으로 두 번째 많다고 밝혔다.
메이드인 코리아 의료 제품과 코로나19 진단 키트에 대한 전 세계적인 관심이 뜨겁다. 주식 시장에서도 코로나 관련 메디컬 회사들이 연일 새로운 역사를 쓰고 있다.
◇전 세계 사용 중인 코로나 진단 제품 약 275개 달해
그렇다면 한국 진단 키트 이외에 현재 구매 가능한 전 세계 COVID-19 테스트 브랜드는 과연 어떤 것들이 있을까? 2020년 3월 31일 현재, 세계보건기구의 진단 기술 평가 협력 기관 중 하나인 FIND 사이트에 따르면, 분자진단 검사 제품과 면역진단 검사 제품 모두 합쳐 약 275개 코로나 진단 제품이 전 세계적으로 사용되고 있으며, 이 외에도 추가 개발 중인 코로나 진단 제품만도 수 십 개에 달한다.
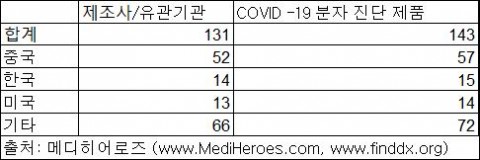
그 중 분자진단 제품은 3월 31일 현재 총 131개의 기관에서 143개의 제품을 상업적으로 판매 사용하는 것으로 파악되며, 중국산 제품이 총 57개, 한국산 제품이 총 15개, 미국산 제품이 총 14개로 집계됐다.
◇미국 식품의약국(FDA) 긴급 사용 승인제품 총 22개(2020년 3월 31일 한국시각 기준)
3월 31일 현재(미국 시각 3월 30일) 미국 식품의약국(FDA) 사이트를 살펴보면 총 22개 기관이 개발한 22개 COVID-19 진단 제품이 긴급 사용 승인(Emergency Use Authorization, EUA)을 받았으며, 이 리스트에 이름을 올린 한국 제품은 아직 없다.
국내 언론 보도에 따르면 3월 28일 외교부가 공개한 미국 식품의약국(FDA)으로부터 잠정 승인 또는 사전 승인이라는 용어에 대해 국내에서 여러가지 논란이 있었다. 3월 16일 미국 식품의약국(FDA) 홈페이지에 게재된 ‘응급 보건 상황시 코로나 진단 테스트 정책(Policy for Diagnostic Tests for Coronavirus Disease-2019 during the Public Health Emergency)’에 따르면, 코로나 진단 제조사뿐만 아니라 미국 CLIA 승인을 받은 검진 센터((laboratories certified under Clinical Laboratory Improvement Amendments))들이 구매한 진단 제품 또는 연구용 제품(Research Use Only, RUO)으로 승인받은 제품으로 자체 설계 개발한 진단 제품의 유효성(validation) 검사를 마친 후 환자에 대한 검사를 진행할 수 있도록 허용하고 있기 때문에, FDA 긴급 사용 승인을 받지 않은 한국산 코로나 진단 제품들이 이미 미국 내에서 사용되고 있을 가능성이 있다.
진단 제품 제조사가 아니더라도, 고난이도 진단 역량을 보유한 검진센터가 연구용 진단 제품을 직접 구매하여, 자체적으로 코로나 검진을 할 수 있다는 얘기다. 메디히어로즈는 미국 FDA에 따르면, 긴급 사용 승인(EUA)을 준비하는데 약 15일(15 business days) 정도면 충분할 것으로 보고 있기 때문에, 외교부가 사전 승인을 받았다고 언급한 세 가지 국산 진단 제품 외에 다른 국산 제품들도 머지않아 미국 식품의약국(FDA) 긴급 사용 승인 리스트에 이름을 올릴 것으로 내다봤다.
3월 13일에 트럼프 대통령이 발표한 메모랜덤(Memorandum on Expanding State-Approved Diagnostic Tests)에 따르면, 뉴욕 주 워즈워스 보건 센터(Wadsworth Center of the New York State Department of Health)를 시작으로 개별 주정부의 책임하에 미국 연방 식품의약국(FDA)과 별도로 코로나19 진단 키트를 자체 개발 및 사용할 수 있도록 승인하되, 관련 책임은 각 주에서 지는 것으로 개별 주에 일정의 자율권을 부여한 바 있다. 나아가 개별 주에서 승인한 코로나19 진단 키트의 검증 결과를 FDA와 공유하도록 강제하는 것이 아니라, 공유할 것을 장려하고 있다.
◇세계보건기구(WHO) 긴급 사용 리스트(Emergency Use Listing)
세계보건기구(WHO)가 3월 20일에 업데이트한 긴급 사용 리스트(Emergency Use Listing)에는 미국 식품의약국(FDA) 긴급 승인 제품 22개 외에도 한국, 브라질, 싱가포르, 호주 등 개별 국가들이 승인한 코로나19 진단 제품의 확인이 가능하다. 세계보건기구의 개별 국가별로 긴급 사용 승인을 받은 진단 제품 리스트(COVID-19 Listing in IMDRF jurisdictions)에는 대한민국 식품의약국안전처에서 긴급 사용 승인을 받은 씨젠, 솔젠트, 코젠바이오텍, SD바이오센서, 바이오세움 다섯개 제조사가 명단에 올라있다.
코로나19 사태 발발 전에 한국 진단 제품의 우수성에도 불구하고, 국내외 판매처를 찾는데 어려움을 겪었던 한국의 많은 제조사들이 이번 코로나 사태를 통해 제품의 진가를 인정받은 것은 매우 고무적인 일이다. 하지만 미국 FDA에 뿐만 아니라 다른 나라에서 사용 중인 코로나 진단 제품은 정식 허가를 받은 것이 아니라 긴급 사용 승인을 받은 것에 불과하기 때문에, 현재의 코로나 긴급 상황의 종료와 더불어 사용이 불가하다고 명시되어 있다.
메디히어로즈는 이번 코로나 사태를 맞아 한국 진단 제품의 일시적인 판매 호황으로만 그칠 것이 아니라, 한국 제조업체들이 개별 수출 국가별 정식 허가 절차를 면면히 파악하여 코로나19 사태 종료 후에도 한국의 진단 제품들을 지속적으로 공급할 수 있는 글로벌 네트워크 구축의 계기로 삼길 바란다고 밝혔다.





















